(Madrid).- La investigadora Ana Losada, del Centro Nacional de Investigaciones Oncológicas (CNIO), es la descubridora en vertebrados de la cohesina, una pieza fundamental en la división celular. Losada no ha dejado de pensar en esta proteína desde su primer encuentro con ella, en 1998, en el prestigioso laboratorio Cold Spring Harbor (Nueva York, EEUU). “Es fascinante”, reconoce. Hoy se sabe que la cohesina tiene un papel en muchos tipos de cáncer, así que muchos investigadores en todo el mundo comparten ahora su interés.
Esta semana Losada, jefa del Grupo de Dinámica Cromosómica del CNIO, publica un nuevo hallazgo al respecto en una revista de alto impacto, Cell Reports, con Paco Real, jefe del Grupo de Carcinogénesis Epitelial del CNIO, y Miguel Manzanares, jefe del Grupo de Genómica Funcional del Centro Nacional de Investigaciones Cardiovasculares (CNIC) y actualmente del Centro de Biología Molecular Severo Ochoa, CSIC-UAM (CBMSO) como coautores. Andrés Hidalgo, jefe del Grupo de Imagen de la Inflamación Cardiovascular y la Respuesta Inmune del CNIC, ha participado también en el estudio.
La cohesina se ocupa de preparar los cromosomas para la división celular, formando un complejo en forma de anillo que abraza el ADN. En las imágenes clásicas de una célula dividiéndose se ven cromosomas duplicados justo antes de separarse pero aún unidos por el centro, formando una X; la cohesina es la proteína que hace posible esa unión temporal –el proceso de división de una célula dura menos de una hora- permitiendo a las células hijas recibir una copia de cada par cromosómico.
Fue identificada primero en mutantes de levadura, pero la levadura es un ser unicelular; Losada la encontró en un anfibio, la rana de uñas africana (Xenopus laevis), cuya cohesina es más parecida a la nuestra. Se abrió así un nuevo campo de investigación que ha atraído a numerosos grupos en todo el mundo. Hay mucho por estudiar. La cohesina “se ha conservado casi tal cual en especies muy distintas a lo largo de millones de años de evolución, y eso nos dice que tiene una función muy importante”, explica Losada.
Pronto se descubrió que, además de mantener unidas las dos copias de los cromosomas antes de la división celular, la cohesina “participa en la disposición espacial del genoma, en la manera en que se coloca”, explica. La cohesina ayuda a que la molécula de ADN se pliegue de la manera correcta, importante para que la información en los genes pueda ser leída en el momento y en el tipo celular apropiado.
Hace unos cinco años se descubrió que la cohesina está mutada en numerosos tipos de cáncer. En el de vejiga, en concreto, las mutaciones relacionadas con ella son de las más comunes, según han hallado los grupos del CNIO lideraros por Paco Real y Núria Malats. Además, algunas mutaciones en la cohesina y otras proteínas que regulan su función están en el origen de las enfermedades raras conocidas con el nombre de cohesinopatías. Estos hallazgos han redoblado el interés internacional en el estudio de la cohesina.
Ahora Losada ya no trabaja con ranas sino con ratones, el animal modelo estrella en el CNIO. Y su investigación está desvelando pieza a pieza cómo trabaja la cohesina y qué pasa cuando no funciona bien.
“En realidad la cohesina no es una única proteína, es un complejo de cuatro proteínas juntas”, explica. “En todas las células hay dos versiones de este complejo, uno con una subunidad llamada STAG1 y otro con la subunidad STAG2. Son parecidas pero no iguales, así que queremos entender por qué están ahí, qué hacen y qué consecuencias tiene para la célula perder una u otra versión”.
Esencial en embriones, prescindible en adultos
Aunque es una pregunta motivada por la curiosidad, la respuesta tendrá, con toda seguridad, implicaciones en la comprensión del cáncer y otras enfermedades.
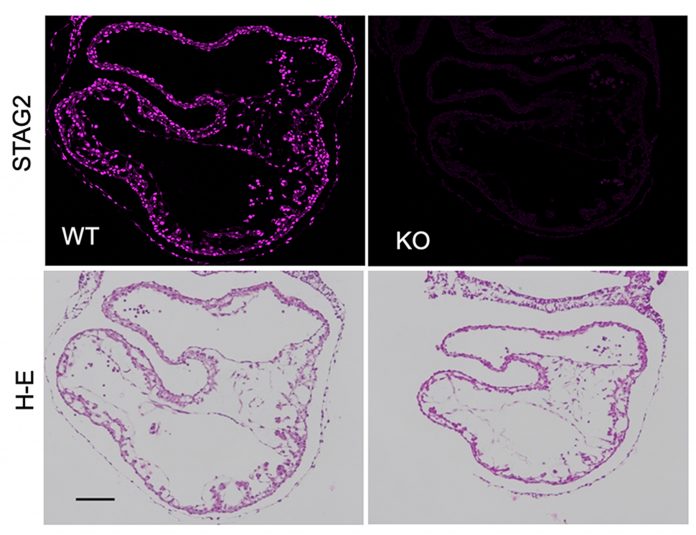
En el trabajo que ahora publican en Cell Reports, Losada, Real y Manzanares han creado un ratón en el que es posible inactivar la proteína STAG2 en distintas etapas de desarrollo, incluida la vida adulta. Comprueban que STAG2 es en gran medida prescindible en animales adultos; su inactivación en todos los tejidos no da lugar a tumores, aunque empeora el estado de salud de los animales.
Sin embargo, en la etapa embrionaria STAG2 es indispensable: sin ella, los embriones mueren. Su desarrollo va muy retrasado, y los investigadores observan además defectos en el proceso de formación del corazón.
Parece una pieza pequeña del rompecabezas, pero la información que aporta ayudará a entender cómo funcionan las células, y el organismo en su conjunto. “Nuestros resultados aportan evidencias concluyentes de que los diferentes complejos de la cohesina cumplen una función específica en distintas células y tejidos, y de que su mal funcionamiento contribuye a la enfermedad”, concluyen los autores en Cell Reports.
El trabajo ha sido financiado por el Ministerio de Ciencia e Innovación, el Instituto de Salud Carlos III, la Agencia Estatal de Investigación, el Fondo Europeo de Desarrollo Regional, la Asociación Española Contra el Cáncer (AECC) y la Fundación Pro CNIC.