(Madrid).- Un estudio internacional dirigido por investigadores del Consejo Superior de Investigaciones Científicas (CSIC) ha identificado algunas claves de la flexibilidad de la proteína spike del coronavirus SARS-CoV-2, que es fundamental para permitir la entrada del virus en las células y propagar la infección. Este conocimiento, publicado en la revista International Union of Crystallography Journal, podría ser útil en el diseño de terapias para bloquear el acceso del virus al interior de las células.
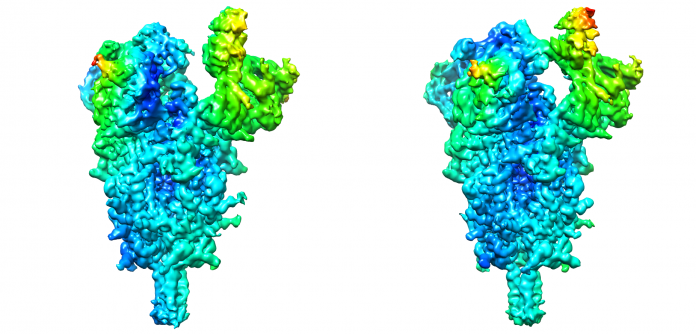
Los investigadores han definido por primera vez de forma cuantitativa los movimientos de la proteína spike y proponen la localización de algunas bisagras moleculares que permiten estos movimientos. Para analizar estos movimientos y la dinámica estructural de esta proteína, los investigadores han desarrollado nuevos métodos computacionales mediante el estudio de cientos de miles de imágenes de crío-microscopía electrónica.
Animación que muestra algunos de los cambios estructurales que se producen en la espícula de SARS-CoV-2. El vídeo comienza con el mapa de potencial electrostático, con zonas estructuralmente muy estables en azul, muy inestables en rojo, y de una inestabilidad intermedia en verde. Posteriormente, prosigue mostrando un esquema simplificado del esqueleto de las proteínas, con colores distintos para las diferentes proteínas que conforman la espícula.
El trabajo ha sido realizado por varios grupos de investigación del Centro Nacional de Biotecnología (CNB-CSIC) -que alberga el Centro de Procesamiento de Imagen de la Infraestructura Europea de Biología Estructural Instruct-ERIC- y del Centro de Química Física Rocasolano (IFQR-CSIC), en colaboración con la Universidad Autónoma de Madrid, la Universidad de Yale y la Universidad de Texas. El estudio ha contado con el apoyo del Instituto de Física de Cantabria (CSIC-UC) y del Centro de Supercomputación de Barcelona.
José María Carazo, investigador del CNB-CSIC y uno de los responsables del trabajo, destaca que: “mediante los nuevos desarrollos propuestos en análisis de imagen hemos podido comenzar a entender la flexibilidad de la espícula infectiva del virus, detectando algunas de las bisagras moleculares que facilitan su entrada en la célula. Para lograrlo hemos estudiado cientos de miles de imágenes de microscopía electrónica en condiciones criogénicas, hemos colaborado con grupos de trabajo en España y Estados Unidos, y hemos utilizado recursos computaciones en diferentes instituciones, logrando resultados impensables sólo hace unos años y en un tiempo récord”. “De esta forma, hemos podido identificar el movimiento que sigue la proteína S para fusionarse con las membranas celulares”.
Roberto Melero, primer autor del trabajo, junto con Carlos Óscar Sánchez Serrano, señala: “este trabajo prueba la existencia de una flexibilidad continua y característica en la proteína S del SARS-CoV-2 que no habíamos sido capaces de detectar previamente, y que podría ser útil en el diseño de nuevas terapias dirigidas a bloquear la entrada del virus en la célula”.